Se han terminado las flores del jarrón, pero aún hay floreros que no cumplen con la condición del cliente. ¿Qué podrías hacer?
VER























1

1

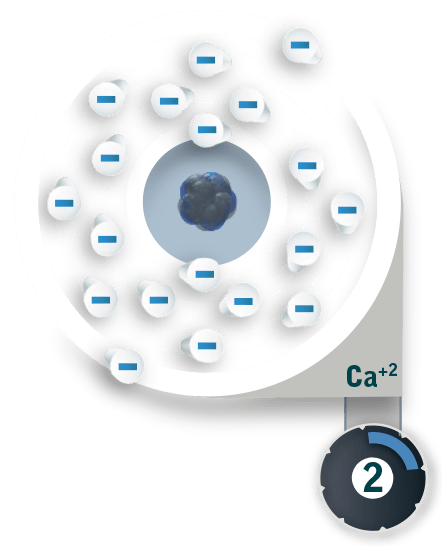
¡Continúa! El núcleo atómico está constituido por dos partículas fundamentales. El protón cuya carga es positiva y el neutrón cuya carga es neutra. X Los electrones son las partículas fundamentales que se encuentran alrededor del núcleo atómico y poseen una carga negativa. X CompuestoNaCl Los átomos están constituidos de protones, neutrones y electrones. En su estado basal, los átomos poseen el mismo número de protones que de electrones lo que le otorga una carga eléctrica neutra. X Cuando un átomo tiene diferente número de electrones y protones, su carga deja de ser neutra. Al suceder esto adquiere el nombre de ion. El sodio (Na) al donar un electrón al cloro (Cl), tiene más protones que electrones y se convierte en el ion sodio (Na+), a su vez el cloro (Cl) tiene más electrones que protones y se convierte en el ion cloruro (Cl-). Continuar Piensa bien. Cuándo ahorras más energía, ¿moviendo una flor o moviendo siete? ¡Vuelve a intentarlo! Repite el ejercicio realizando un mismo tipo de movimiento. Poner una flor y luego quitarla implica un mayor número de movimientos y buscamos realizar el menor esfuerzo posible. ¡Vuelve a intentarlo! En este caso, para cumplir con la condición de hacer la menor cantidad de movimientos, basta con pasar una flor del florero de la izquierda al de la derecha. Observa la configuración final.