Ficha temática
ASIGNATURA: Química
Temas:
- Estructura del átomo según el modelo de Bohr.
- Construcción de átomos de diversos elementos.
- Configuración electrónica de los elementos.
CRÉDITOS
Contenido elaborado por las profesoras de la asignatura Química I del Colegio de Ciencias y Humanidades:
- Wendy Beatriz Pérez Báez María Patricia García Pavón Sylvia Gpe. Martínez Galindo Blanca Estela Quiza Gaytán Idea original y contenidos
- Rocío Angélica Hernández Rodríguez Coordinación de diseño didáctico
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
- Pablo Enrique Zenil Rivas Desarrollo de sistemas
- Diana Gabriela Guzmán Sánchez Diseño gráfico
- Mario Alberto Hernández Mayorga Coordinación del desarrollo
- Teresa Vázquez Mantecón Coordinación del proyecto
Los átomos y su estructura
Introducción
La tabla periódica es un recurso que utilizas de manera sistemática a lo largo del estudio de la química. Según Ebbing y Gammon (2010) se le llama tabla periódica al "arreglo tubular de elementos en periodos y grupos destacando la repetición regular de las propiedades de los elementos". En ella se organizan los elementos en grupos representativos considerando los electrones de valencia de cada uno de ellos.
En este material aprenderás a utilizar la información que está en la tabla periódica, de manera que identifiques los elementos químicos, a partir de su símbolo y nombre, clasificándolos en metales y semimetales para comprender las propiedades periódicas.
Lo anterior se hace importante ya que al usar y manejar la información de la tabla periódica podrás utilizarla en el estudio de las ciencias, no sólo de la química, también de la biología, física y otras más.
Estructura del átomo
Conocer la estructura interna del átomo es esencial, ya que si bien la
organización de los elementos químicos en la tabla periódica se realizó en función
de las propiedades de estas sustancias, es el
conocimiento de la distribución de electrones en el átomo lo que nos ayuda a comprender
la naturaleza del orden periódico, es decir, nos ayuda a explicar porqué razón los elementos presentan propiedades
físicas y químicas semejantes cuando se encuentran en una familia, y
también nos apoya para distinguir porqué un elemento es distinto de otro.
Para fines de este material solo se trabajará con el modelo de Bohr.
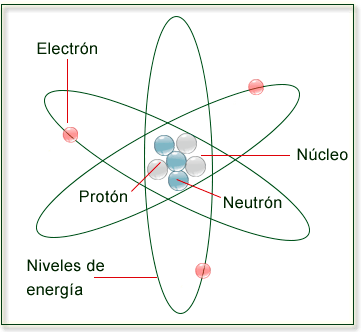
Estructura del átomo
Núcleo:
Es la región más densa del átomo, se ubica en el centro y en éste se encuentran los protones y los neutrones, esta zona concentra el total de la masa, por ello el número de neutrones y protones determina el NÚMERO DE MASA.
Protones + Neutrones = Número de masaMasa atómica:
Es el promedio del número de masa de todos los isótopos de un elemento, por eso se obtienen valores decimales.
Protones:
Partículas subatómicas con carga positiva, se localiza en el núcleo y tiene un peso de 1.673x10-24 g.
Al conjunto de protones de un átomo se le conoce como NUMERO ATÓMICO, es decir, si un átomo posee 3 protones, su número atómico será 3.
Estructura del átomo
Neutrones
Partículas subatómicas sin carga que se localizan en el núcleo, estos dan origen a los ISÓTOPOS de los diferentes elementos.
El número de neutrones suele calcularse de la siguiente forma:
Número de Neutrones = número de masa – número atómico
Llamamos ISÓTOPOS a los átomos con el mismo número atómico pero que difieren en su masa atómica debido a que poseen el mismo número de protones pero con diferente número de neutrones.
|
1H Hidrógeno ligero
(Protio) |
2H Hidrógeno pesado
(deuterio) |
3H Hidrógeno de peso triple
(tritio) |
| Carbono 12
estable |
Carbono 13
estable |
Carbono 14
inestable (radiactivo) |
Estructura del átomo
Electrones:
Partículas subatómicas con carga negativa que se encuentran alrededor del núcleo con un peso de 9.1 x 10-28g.
número de electrones en un átomo neutro es igual al número de protones
Nivel de energía:
De acuerdo al modelo postulado por Bohr, los electrones giran en órbitas alrededor del núcleo en donde les corresponde cierto nivel de energía (n).
El número de niveles de energía que un átomo puede tener puede ser de 1 a 7 y se representan con las letras mayúsculas K, L, M, N, O, P y Q.
Cada nivel de energía puede contener un número determinado de electrones.
| Nivel de energía | Letra | No. de electrones |
| n=1 | K | 2 |
| n=2 | L | 8 |
| n=3 | M | 18 |
| n=4 | N | 32 |
| n=5 | O | 32 |
| n=6 | P | 18 |
| n=7 | Q | 8 |
Estructura del átomo
Nivel de energía:
Los niveles de energía corresponden en la tabla periódica a los periodos. En el siguiente ejemplo el sodio tiene tres niveles de energía, por tanto está en el tercer periodo de la tabla:
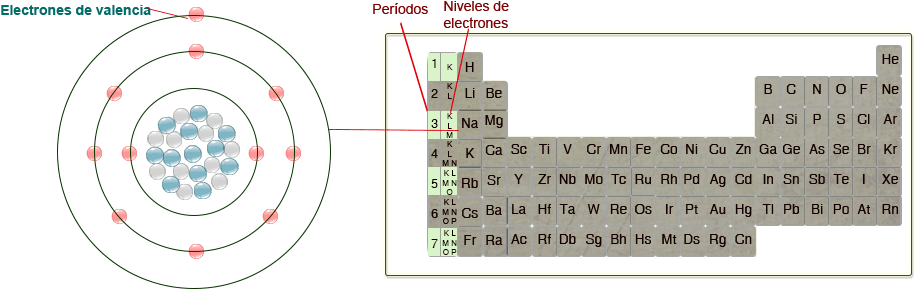
En un átomo neutro, a los electrones que se encuentran en el último nivel de energía se les conoce como ELECTRONES DE VALENCIA, éstos son muy importantes porque en una familia de elementos todos tienen el mismo número de electrones de valencia.
Fábrica de átomos
- Selecciona el elemento en la tabla periódica del que quieres formar el átomo.
- De acuerdo a la masa atómica arrastra el número de protones que dicho átomo tiene al centro del mismo.
- Ahora arrastra el número de neutrones que el átomo contiene.
- A partir de los resultados llena la tabla, al finalizar toca en Verificar para que compares tus respuestas.









